末梢動脈疾患の病因
末梢動脈疾患の症状と徴候
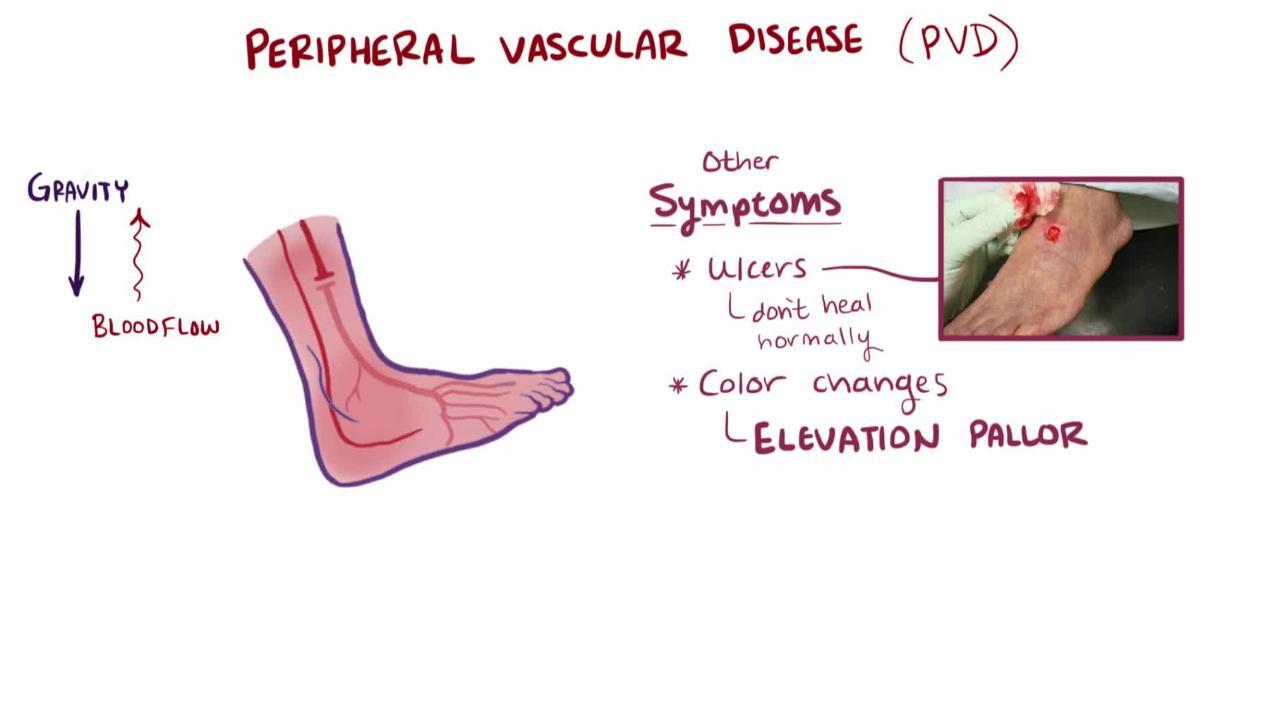
間欠性跛行は,末梢動脈疾患の典型的な臨床像である。間欠性跛行では,歩行していると下肢に痛み,疼き,痙攣,不快感,疲労感などが生じ,安静により軽快する。跛行は通常は腓腹部に起こるが,足,大腿部,股関節,殿部,またはまれに腕にも起こりうる。跛行は運動誘発性の可逆的な虚血の臨床像であり,この点は狭心症と同様である。PADの進行とともに,症状が現れることなく歩行できる距離が短縮したり,重度のPAD患者では安静時から疼痛が生じたりすることがあり,これらは不可逆的な虚血を反映している。安静時痛は通常,遠位でより強く,下肢の挙上により悪化し(しばしば夜間に痛みを引き起こす),下肢が心臓より低い位置にあると軽減する。疼痛は灼熱感,絞扼感,疼きなどの性状を呈するが,この所見は非特異的である。
末梢動脈疾患患者の約20%は無症状であるが,これはときに患者が下肢の虚血を誘発するほどの活動を行わないことに起因する。一部の患者では非定型症状(例,非特異的な運動耐容能低下,股関節痛や他の関節の痛み)がみられる。
軽度のPADはしばしば何の徴候も示さない。中等度から重度のPADでは,一般的に末梢動脈(膝窩動脈,後脛骨動脈,足背動脈)で脈拍の減弱または消失がみられる。
足が心臓より低い位置にある場合に暗赤色を呈することがある(下垂時の発赤[dependent rubor]と呼ばれる)。一部の患者では足の挙上により色が喪失し,虚血による痛みが悪化する;足を下ろした際には,静脈の充満に時間がかかる(15秒以上)。患者が痛みを和らげるために下肢を動かさず,下垂させたままでいる場合を除き,浮腫は通常みられない。慢性PADでは,菲薄化して蒼白な(萎縮した)皮膚を呈し,体毛が薄くなるか脱落することがある。下肢遠位部および足に冷感を認めることがある。患側の下肢で過度の発汗とチアノーゼを呈することがあり,これはおそらく過剰な交感神経緊張に起因する。
DR P. MARAZZI/SCIENCE PHOTO LIBRARY
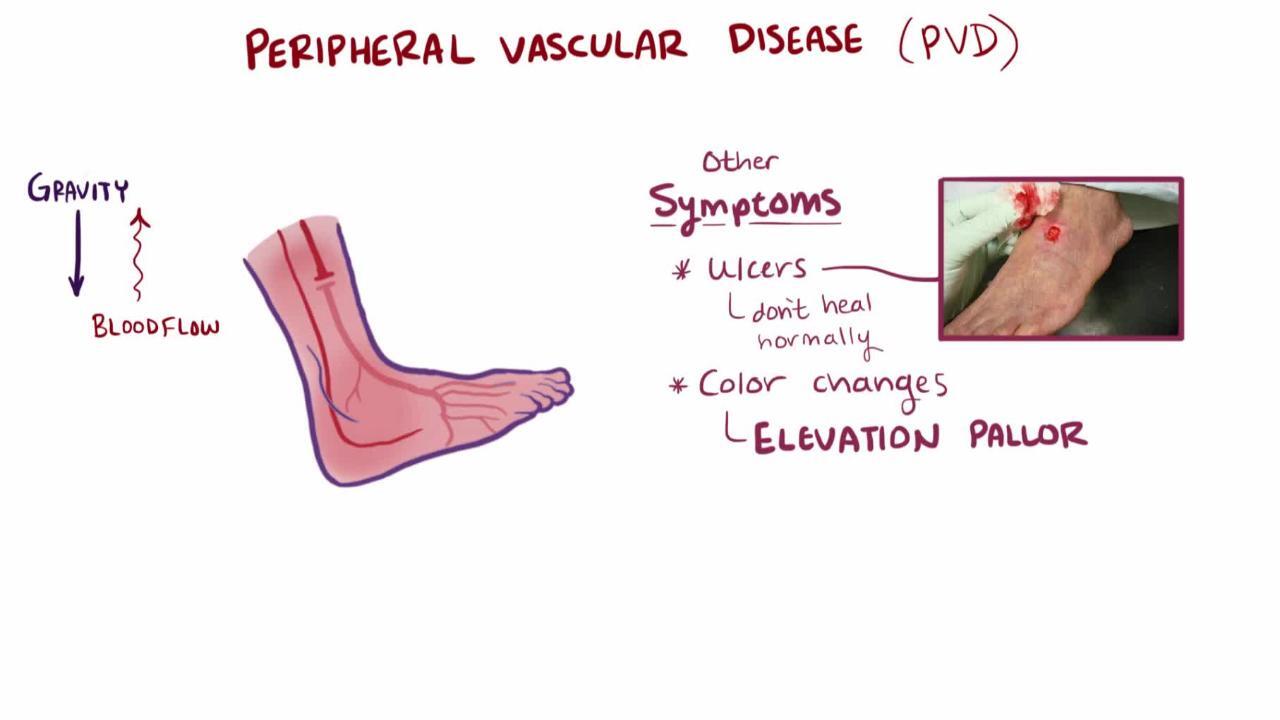
虚血の悪化に伴い,潰瘍が出現することもあり(典型例では足趾または踵部,ときに下肢または足),特に局所の外傷後によくみられる。潰瘍は黒い壊死組織に取り囲まれる傾向がある(乾性壊疽)。通常は痛みを伴うが,末梢神経障害(例,糖尿病やアルコール使用症によるもの)のある患者は痛みを感じないことがある。虚血性潰瘍の感染(湿性壊疽)は容易に起こり,進行の速い蜂窩織炎を引き起こす。
動脈閉塞のレベルが症状の部位に影響を及ぼす。大動脈-腸骨動脈のPADでは,殿部,大腿部,または腓腹部の跛行,股関節痛,および男性では勃起障害が生じることがある(Leriche症候群)。大腿膝窩動脈のPADでは,跛行は典型的には腓腹部に起き,大腿動脈より下位の脈拍は弱いか触知できない。より遠位の動脈に生じたPADでは,大腿膝窩動脈の拍動は触知できることがあるが,足部の脈拍は認められない。
動脈閉塞性疾患は,ときに腕(特に左鎖骨下動脈近位部)で発生することもあり,労作時の腕の疲労感をもたらし,ときに手の塞栓症を引き起こす。
末梢動脈疾患の診断
足関節上腕血圧比
超音波検査
手術前の血管造影
© 2017 Elliot K.Fishman, MD.
末梢動脈疾患は臨床的に疑われるが,多くの患者は症状が典型的でないか症状を呈するほど活動的ではないため,十分に認識されていない。脊柱管狭窄症も歩行中の下肢痛の原因となりうるが,その疼痛(pseudoclaudicationと呼ばれる)の軽減には安静だけでなく座位をとる必要があり,また末梢の脈拍が完全なままであることから鑑別可能である。
診断は非侵襲的検査により確定される。最初に,両側の上肢および足関節で収縮期血圧を測定する;足関節の脈拍は触知が難しいことがあるため,ドプラ超音波検査用のプローブを足背動脈または後脛骨動脈の上に置いて測定してもよい。大動脈-腸骨動脈のPAD単独の症例を大腿膝窩動脈のPADおよび下腿のPADと鑑別する上では圧較差と容積脈波が役に立つことから,ドプラ超音波検査がしばしば用いられる。
足関節上腕血圧比とは,上肢で測定した収縮期血圧に対する足関節で測定した収縮期血圧の比である。足関節上腕血圧比の低値(≤ 0.90)はPADを示唆し,以下のように分類できる:
軽度:0.71~0.90
中等度:0.41~0.70
重度:≤ 0.40
血圧比は正常(0.91~1.30)であるが依然としてPADが強く疑われる場合は,運動負荷試験後に血圧比を測定する。血圧比の高値(> 1.30)は,下肢血管が圧迫されなくなっていること(動脈壁の石灰化を伴うメンケベルグ型動脈硬化症において起こる現象)を示唆する。
血圧比が1.30を超えているものの,それでもPADが強く疑われる場合は,動脈の狭窄または閉塞がないか確認するため,追加の検査(例,ドプラ超音波検査,足趾用カフを用いた第1趾での血圧測定)を行う。収縮期血圧が糖尿病患者以外で55mmHg未満,または糖尿病患者で70mmHg未満の場合,虚血性病変は治癒する可能性が低くなる;膝下切断の術創は,血圧が70mmHg以上であれば通常は治癒する。
末梢動脈の機能不全は,経皮的酸素分圧(TcO2)でも評価することができる。TcO2値40mmHg(5.32kPa)未満は治癒不良の予測因子であり,20mmHg(2.66kPa)未満は極めて重度の四肢虚血と一致する。
血管造影では動脈狭窄または閉塞の部位および範囲を詳細に調べることができ,外科的修復または経皮的血管形成術(PTA)を施行する上で前提となる検査である。血管造影は異常所見の機能的意義に関する情報をもたらさないことから,非侵襲的検査を代用するものではない。MRアンギオグラフィーとCT血管造影は,カテーテルを用いる血管造影に代わる非侵襲的検査である。
末梢動脈疾患の治療
危険因子の是正
運動
抗血小板薬
ときに跛行に対するペントキシフィリンまたはシロスタゾール
アンジオテンシン変換酵素(ACE)阻害薬
重症例に対する経皮的血管形成術(PTA)または手術
末梢動脈疾患の症状緩和および心血管疾患(CVD)の予防のため,全例で積極的な危険因子の是正が必要であり,具体的には以下のものある:
禁煙(必須)
糖尿病,脂質異常症,および高血圧のコントロール
体系化された運動療法
食習慣の改善
スタチン系薬剤,ACE阻害薬,およびアスピリンを投与して,CVDのリスクを低減する(動脈硬化の治療を参照)。あるランダム化プラセボ対照試験では,アスピリン単剤に低用量リバーロキサバンを追加することで,CVDイベントおよび重大な四肢の有害事象(切断など)が減少することが示された(1)。下肢の血行再建術を必要とする重度の末梢動脈疾患患者については,別の研究において,リバーロキサバン2.5mg,経口,1日2回とアスピリンの併用による術後療法により,急性四肢虚血,血管系の原因による重大な四肢切断(major amputation),心筋梗塞,虚血性脳卒中,または心血管系の原因による死亡の複合アウトカムの発生率がアスピリン単剤と比較して有意に低下したことが実証された(2)。
β遮断薬は,PADが非常に重度でない限り,安全である(3)。
運動(35~50分間のトレッドミルまたはトラックの歩行を運動・安静・運動のパターンで週3~4回実施)が重要であるが,十分に実践されていない治療法である。監督下での運動プログラムは,非監督下でのプログラムより,おそらく優れているようである。運動は無症状で歩ける距離を延長させ,生活の質を改善する。その機序としては,側副血行路の増加,微小血管の拡張を伴う内皮機能の向上,血液粘稠度の低下,赤血球の濾過性の向上,虚血に誘発された炎症の軽減,酸素抽出の増大などが想定されている。
下肢を心臓より低い位置に保つように患者に助言する。夜間の疼痛を軽減するためには,足への血流を改善するためにベッドの頭側を約10~15cm挙上させてもよい。
また,寒冷刺激への曝露と血管収縮を引き起こす薬物(例,コカイン,アンフェタミン類)や薬剤(例,多くの鼻閉改善薬や感冒薬に含まれているプソイドエフェドリン)の使用を避けるよう患者に助言する。
予防的なフットケアが重要であり,特に糖尿病患者では極めて重要である。これには,外傷や病変に関する毎日の足の視診;足専門医(podiatrist)による胼胝および鶏眼の治療;毎日の足の洗浄(低刺激性の石鹸と微温湯で洗浄した後,ゆっくりと完全に乾燥させる);熱傷,化学損傷,および機械的損傷(特によく合っていない履き物による損傷)の回避などがある。足潰瘍の管理については,本マニュアルの別の箇所で考察されている。
薬物治療
末梢動脈疾患の患者において,抗血小板薬は症状をいくらか軽減し,歩行距離を延長させる可能性があるほか,より重要なこととして,アテローム形成を緩和して,急性冠症候群および一過性脳虚血発作の予防に役立つ。症状のあるPAD患者に対する選択肢としては,アスピリン単剤(75~325mg,経口,1日1回)やクロピドグレル単剤(75mg,経口,1日1回)などがある(3)。アスピリン(100mg,経口,1日1回)と低用量リバーロキサバン(2.5mg,経口,1日2回)の併用は,心血管疾患の発生率を低下させるが,出血リスクを増大させることを示唆したデータもある(4)。
跛行の軽減には,ペントキシフィリン400mg,経口,1日3回を食事とともに投与するか,シロスタゾール100mg,経口,1日2回の投与を行い,患部の血流を改善して組織の酸素化を促進することによって間欠性跛行を軽減することができるが,ペントキシフィリンとシロスタゾールのいずれも危険因子の是正と運動に代わるものではない。ペントキシフィリンの使用については,その有効性のエビデンスが一貫していないため,議論のあるところである。ペントキシフィリンの有害作用はまれで軽度であるため,2カ月以上の試験的投与も正当化されると考えられる。シロスタゾールの最も頻度の高い有害作用は頭痛および下痢である。シロスタゾールは,重度の心不全がある患者では禁忌である。
ACE阻害薬とアンジオテンシンII受容体拮抗薬(ARB)はいくつかの有益な作用を示す。これらはアテローム形成を抑制する,強力な血管拡張薬である。四肢を脅かす慢性虚血に対して血管治療を受けた患者のうち,ACE阻害薬またはARBを服用していた患者では,無切断生存期間および全生存期間が改善した(5)。
跛行を軽減する可能性のある他の薬剤についても研究が行われており,具体的にはL-アルギニン(内皮依存性血管拡張薬の前駆体),一酸化窒素,血管拡張性プロスタグランジン,および血管新生増殖因子(例,血管内皮増殖因子[VEGF],塩基性線維芽細胞増殖因子[bFGF])などがある。重度の四肢虚血患者では,血管拡張性プロスタグランジン注射剤の長期投与により疼痛を軽減して,潰瘍の治癒を促進する可能性がある。
経皮的血管形成術(PTA)
閉塞血管を拡張させる上では,PTAの単独施行またはステント留置との併用が外科手術によらない第一の手段である。ステントを内挿するPTAは,バルーンによる圧迫のみと比較して,動脈の開存をより良好に維持し,再閉塞率が低いと考えられる。ステントは血流の速い太い動脈(腸骨動脈および腎動脈)において最も効果があり,細い動脈や閉塞が長い場合には,それほど有用ではない。
PTAの適応は手術の適応と同様である:
日常生活に支障を来し,かつ危険因子の是正と非侵襲的治療に反応しない間欠性跛行
安静時の疼痛
壊疽
適切な病変は,血流を制限する腸骨動脈の短い狭窄(3cm未満)と浅大腿-膝窩動脈領域の単発性または多発性の短い狭窄である。浅大腿動脈の完全閉塞(最長10~12cm)でも拡張は成功しうるが,結果は5cm以下の閉塞の方が良好である。PTAは大腿-膝窩動脈バイパスの近位側にある限局性の腸骨動脈狭窄にも有用である。
PTAはびまん性の病変,閉塞部位の長い病変,偏心性の石灰化プラークにはそれほど有用ではない。そのような病変は特に糖尿病患者でよくみられ,しばしば細い動脈を侵す。
PTAの合併症としては,拡張部位における血栓症,末梢での塞栓,フラップによる閉塞を伴う内膜解離,ヘパリンの使用に関連する合併症などがある。
患者を適切に選択した場合,腸骨動脈,大腿動脈,および腓腹部動脈の狭窄に対するPTAは高い成功率を残す。あるシステマティックレビューとメタアナリシスでは,12カ月後の救肢率が95%,標的病変の血行再建術施行率が14~25%,生存率が90%であったことが報告されている(6)。しかしながら,再狭窄率が33~62%であった;PTAの再施行が成功することがある。
手術
手術は以下に該当する患者で適応となる:
大血管手術に安全に耐えられる
非侵襲的治療に反応しない重度の症状がみられる
目標は症状の軽減,潰瘍の治癒,および肢切断の回避である。多くの患者は基礎疾患として冠動脈疾患を有しており,そのためPADの外科手術中に急性冠症候群が発生するリスクがあるため,通常は手術前に心臓の評価を行う。
血栓内膜除去術(閉塞病変部の外科的除去)は,大動脈-腸骨動脈,総大腿動脈,または深大腿動脈の限局的で短い病変に対して用いられる。
血行再建術(例,大腿-膝窩動脈バイパス術)では,閉塞病変をバイパスするために人工または自家(しばしば伏在静脈またはその他の静脈)材料を使用する。血行再建術は肢切断を予防し,跛行を軽減する上で有用である。
血管の大手術を受けることができない患者では,末梢の閉塞が重度の虚血痛を引き起こしている場合,交感神経切除術が効果的となることがある。化学的な交感神経ブロックが外科的な交感神経切除術と同等に効果的であるため,後者はほとんど行われていない。
肢切断は最後の手段としての手術であり,コントロール不良の感染,耐え難い安静時痛,および進行性の壊疽がみられる場合に適応となる。切断は,義足を最も有効に使用できるように膝関節を残すため,できるだけ末梢で行うべきである。
圧迫療法
下肢を外部から空気で圧迫して末梢の血流を増加させる方法は,手術適応のない重症PAD患者に対する救肢の選択肢である。理論的には,浮腫をコントロールし,動脈血流,静脈還流,および組織の酸素化を改善するが,その使用を裏付けるデータは限られている。空気カフまたはストッキングを下腿に装着し,拡張期,収縮期,または両時相の一部の期間にわたってリズミカルに膨らませる操作を,週数回,1~2時間ずつ行う。
幹細胞移植
骨髄幹細胞は細い血管に分化することが可能である。複数の臨床試験において,重症四肢虚血患者の下肢に対する腸骨稜骨髄を採取源とする自家造血幹細胞移植が検討されている。この治療法は全ての患者に適切とは限らないが,重大な四肢切断が必要になるであろう一部の患者には代替の選択肢となることが証明される可能性がある;初期の小規模試験の結果は有望であったが,複数の盲検プラセボ対照試験で便益が示されなかった(7, 8)。
遺伝子治療
遺伝子治療も研究されている(9, 10)。VEGFをコードするDNAの導入は,側副血行路の増殖を促す可能性がある。
治療に関する参考文献
1.Anand S, Bosch J, Eikelboom JW, et al, on behalf of the COMPASS Investigators: Rivaroxaban with or without aspirin in patients with stable peripheral or carotid artery disease: an international, randomized, double-blind, placebo controlled trial.Lancet 391(10117):218–229, 2018.doi: 10.1016/S0140-6736(17)32409-1
2.Bonaca MP, Bauersachs RM, Anand SS, et al: Rivaroxaban in peripheral artery disease after revascularization.N Engl J Med 382:1994–2004, 2020.doi: 10.1056/NEJMoa2000052
3.Gerhard-Herman MD, Gornik HL, Barrett C, et al: 2016 AHA/ACC Guideline on the management of patients with lower extremity peripheral artery disease.Circulation 155:e686–e725, 2017.
4.Hiatt WR, Bonaca MP, Patel MR, et al.Rivaroxaban and Aspirin in Peripheral Artery Disease Lower Extremity Revascularization.Circulation142 (23):2219-2230, 2020.doi/10.1161/CIRCULATIONAHA.120.050465
5.Khan SZ, O'Brien-Irr MS, Rivero M, et al.Improved survival with angiotensin-converting enzyme inhibitors and angiotensin receptor blockers in chronic limb-threatening ischemia. J Vasc Surg 2020;72(6):2130-2138.doi:10.1016/j.jvs.2020.02.041
6.Ipema J, Huizing E, Schreve MA, de Vries JPM, Ünlü Ç.Editor's Choice - Drug Coated Balloon Angioplasty vs. Standard Percutaneous Transluminal Angioplasty in Below the Knee Peripheral Arterial Disease: A Systematic Review and Meta-Analysis. Eur J Vasc Endovasc Surg.2020;59(2):265-275.doi:10.1016/j.ejvs.2019.10.002
7.Rigato M, Monami M, Fadini GP: Autologous cell therapy for peripheral arterial disease: Systematic review and meta-analysis of randomized, nonrandomized, and noncontrolled studies.Circ Res 120(8):1326–1340, 2017.doi: 10.1161/CIRCRESAHA.116.309045
8.Teraa M, Sprengers RW, Schutgens RE, et al: Effect of repetitive intra-arterial infusion of bone marrow mononuclear cells in patients with no-option limb ischemia: The randomized, double-blind, placebo-controlled Rejuvenating Endothelial Progenitor Cells via Transcutaneous Intra-arterial Supplementation (JUVENTAS) trial.Circulation 131(10):851–860, 2015.doi: 10.1161/CIRCULATIONAHA.114.012913
9.Forster R, Liew A, Bhattacharya V, Shaw J, Stansby G: Gene therapy for peripheral arterial disease. Cochrane Database Syst Rev 2018;10(10):CD012058.Published 2018 Oct 31.doi:10.1002/14651858.CD012058.pub2
10.Shimamura M, Nakagami H, Sanada F, Morishita R.Progress of Gene Therapy in Cardiovascular Disease. Hypertension 2020;76(4):1038-1044.doi:10.1161/HYPERTENSIONAHA.120.14478
要点
末梢動脈疾患(PAD)はほぼ全例が下肢で発生する。
50~75%の患者では,脳血管や冠動脈にも有意な動脈硬化が認められる。
症状を呈する場合,PADは間欠性跛行を引き起こすが,これは歩行時に生じて安静時に軽減する下肢の不快感で,狭心症と同様,運動により誘発される可逆的な虚血の臨床像である。
重度のPADでは安静時にも疼痛が生じることがあり,これは不可逆的な虚血や,足の虚血性潰瘍を反映する所見である。
足関節上腕血圧比(上腕での収縮期血圧に対する足関節での収縮期血圧の比)の低値(0.90以下)はPADを示唆する。
動脈硬化の危険因子を是正し,スタチン系薬剤,抗血小板薬,および,ときにアンジオテンシン変換酵素(ACE)阻害薬,リバーロキサバン,ペントキシフィリン,またはシロスタゾールを投与する。
経皮的血管形成術の単独施行またはステント留置との併用で閉塞血管を拡張できる場合があり,ときに手術(動脈内膜摘除術またはバイパス術)が必要である。